燃料电池原理
燃料电池是一种将化学能直接转化为电能的装置,其基本原理是通过电化学反应实现能量转换。
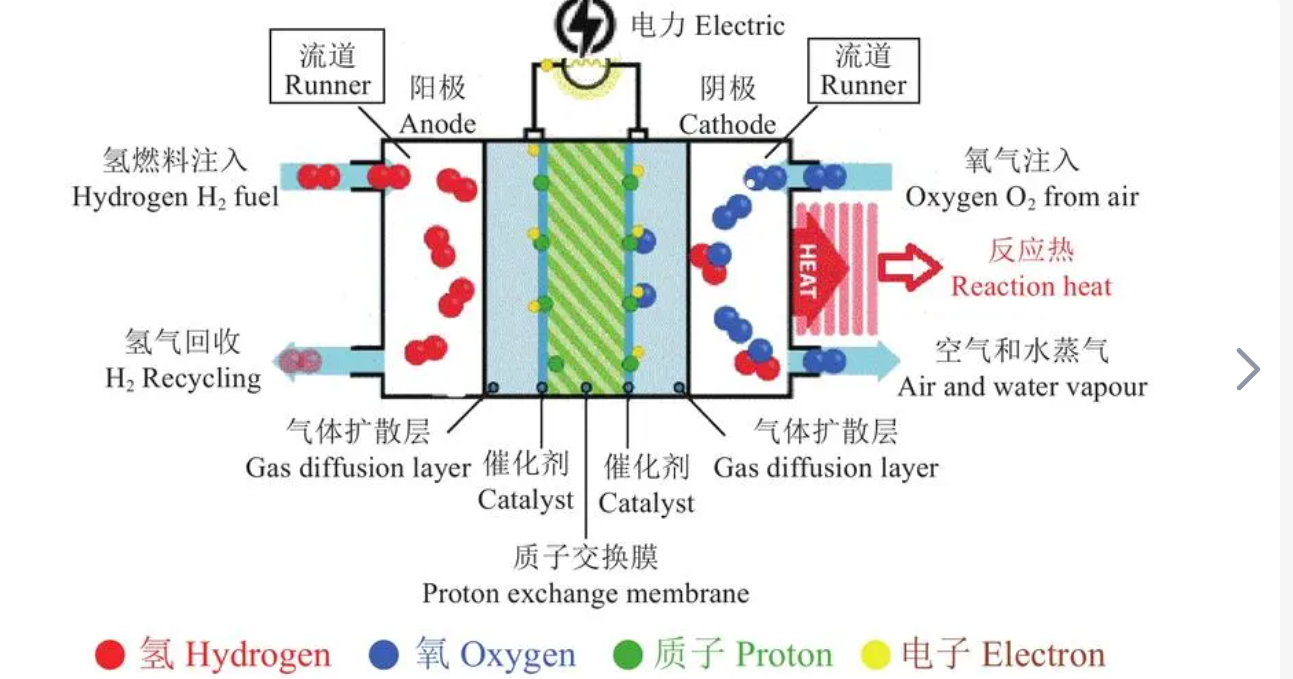
燃料电池的工作原理如下:
- 氢气供应:燃料电池使用氢气作为燃料。氢气可以通过多种方法获得,例如水电解、天然气重整、生物质转化等。在一些类型的燃料电池中,还可以使用其他可燃气体,如甲醇或天然气。
- 氢气在阳极的氧化反应:在燃料电池的阳极(负极),氢气(H2)被氧化成质子(H+)和电子(e-)。这个过程可以用以下方程式表示:
H2 → 2H+ + 2e-
- 电解质传导:在燃料电池中存在一个电解质层,通常是一个质子交换膜(PEMFC)或氧化物固体电解质(SOFC)。电解质层只允许质子通过,而阻止电子通过。
- 电子流动:由于电子无法通过电解质层,它们被迫沿着外部电路流动,从阳极到阴极,形成电流。这个电流可以用于驱动外部设备或充电电池。
- 氧气供应和还原反应:在燃料电池的阴极(正极),氧气(通常是空气中的氧气)被还原成水(H2O)。这个过程可以用以下方程式表示:
O2 + 4H+ + 4e- → 2H2O
- 产生的水排出:通过还原反应产生的水可以从燃料电池中排出。
总的来说,燃料电池通过将燃料(如氢气)在阳极氧化产生质子和电子,利用质子交换膜或固体电解质阻止电子流动,使电子沿外部电路流动产生电流,同时在阴极上与氧气还原生成水。这个过程实现了化学能到电能的直接转换,而且不产生有害的排放物,是一种清洁高效的能源转换技术。
声明:本文来自【火眼甄芯】,未经允许,禁止转载,否则依法追究法律责任;文中图片部分来自于互联网,如有侵权,请联系删除,邮箱:2150693245@qq.com。

最新内容
-
2024-06-12
-
2024-06-03
-
2024-05-22
-
2024-05-22
-
2024-05-09



